***
دیالیز صفاقی (PD) نوعی دیالیز است که از صفاق در شکم شخص به عنوان غشایی استفاده میشود که از طریق آن مایعات و مواد حل شده با خون رد و بدل میشوند. که برای از بین بردن مایعات اضافی، و رفع مشکلات الکترولیت و از بین بردن سموم در افراد با نارسایی کلیه استفاده میشود. دیالیز صفاقی نتایج بهتری نسبت به همودیالیز طی دو سال اول دارد. مزایای دیگر شامل انعطافپذیری بیشتر و تحمل بهتر در افراد دارای بیماری قلبی قابل توجه است.
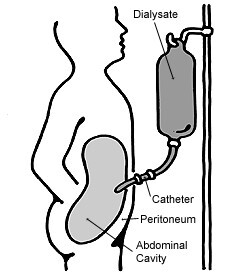
در دیالیز صفاقی، یک محلول خاص از طریق یک لوله دائمی در قسمت تحتانی شکم وارد شده و سپس خارج میشود؛ که ممکن است در فواصل منظم در طول روز اتفاق بیفتد. محلول به طور معمول از سدیم کلرید، کربنات هیدروژن و یک عامل اسمزی مانند گلوکز ساخته میشود
"راه حل مورد استفاده برای دیالیز صفاقی در فهرست روش ها و داروهای ضروری سازمان بهداشت جهانی که ایمنترین و موثرترین داروهای مورد نیاز در یک نظام سلامت است قرار دارد."
در کشور ما به این دلیل انجام دیالیز صفاقی اغلب در مناطق دور از شهرها نیز انجام می شد و احتمال اینکه قربانیان دیالیز در مناطق غیر شهری و روستاها وجود داشته باشد و خاک بتواند راحت تر دلیل مرگ را پاک نماید وجود دارد .
نظارت بر تولید، کنترل، صدور مجوزهای بهداشتی محصولات غذایی و آشامیدنی، آرایش و بهداشتی تولید داخل و وارداتی بهمنظور اطمینان از کیفیت و ایمنی و سلامت محصول مطابق با معیارهای ملی مصوب و ضوابط جاری وزارت بهداشت، درمان و آموزش پزشکی میباشد.
بخشی از وظایف وزارت بهداشت، درمان و آموزش پزشکی و در ماده یک وظایف وزارت بهداشت، درمان و آموزش پزشکی عبارتند از:
11- تعیین و اعلام استانداردهای مربوط به:
الف - خدمات بهداشتی، درمانی، بهزیستی و دارویی.
ب - مواد دارویی، خوراکی، آشامیدنی، بهداشتی، آرایشی، آزمایشگاهی، تجهیزات و ملزومات و مواد مصرفی پزشکی و توانبخشی.
ج - بهداشت کلیه مؤسسات خدماتی و تولیدی مربوط به خدمات و مواد مذکور در فوق
12- صدور، تمدید و لغو موقت یا دائم پروانههای:
الف - مؤسسات پزشکی، دارویی، بهزیستی و کارگاهها و مؤسسات تولید مواد خوراکی و آشامیدنی و بهداشتی و آرایشی.
تبصره - صدور مجوزهای صنعتی واحدهای بهداشتی و درمانی توسط وزارت صنایع منوط به تأیید وزارت بهداشت، درمان و آموزش پزشکی است.
ب - ساخت فرآوردههای دارویی و مواد بیولوژیک، خوراکی، آشامیدنی، بهداشتی، آرایشی و آزمایشگاهی و تجهیزات و ملزومات و مواد مصرفیپزشکی و توانبخشی.
13- انجام نظارت و کنترل کیفی مواد مذکور در بند "ب" از قسمت 12 ماده 1 و تعیین ضوابط و مقررات لازم برای موارد مذکور در بند "الف" و"ب" ماده 12.
***
بند 13 قانون تاکید برنظارت و کنترل کیفی و تعیین ضوابط توسط وزارت بهداشت و درمان را دارد. که بروز ماجرای تولید محصول آلوده که در مقطع خرید مواد اولیه نیاز به تاییدیه وزارت بهداشت و درمان دارد و در نظام تولید م.ضوع CGMP پیوستگی و دائمی بودن کنترل در خط تولید را تاکید می کند
CGMP refers to the Current Good Manufacturing Practice regulations enforced by the FDA. CGMP provides for systems that assure proper design, monitoring, and control of manufacturing processes and facilities. Adherence to the CGMP regulations assures the identity, strength, quality, and purity of drug products by requiring that manufacturers of medications adequately control manufacturing operations. This includes establishing strong quality management systems, obtaining appropriate quality raw materials, establishing robust operating procedures, detecting and investigating product quality deviations, and maintaining reliable testing laboratories. This formal system of controls at a pharmaceutical company, if adequately put into practice, helps to prevent instances of contamination, mix-ups, deviations, failures, and errors. This assures that drug products meet their quality standards.
CGMP به مقررات تولید آنی که توسط FDA اعمال می شود، اشاره دارد. CGMP سیستم هایی را ایجاد می کند که طراحی، نظارت و کنترل مناسب فرآیندها و امکانات تولید را تضمین می کند. پیروی از مقررات CGMP هویت، قدرت، کیفیت و خلوص محصولات دارویی را با الزام تولیدکنندگان داروها به اندازه کافی کنترل عملیات حین تولید را تضمین می کند. این شامل ایجاد سیستم های مدیریت کیفیت قوی، تامین مواد اولیه با کیفیت مناسب، ایجاد روش های عملیاتی قوی، شناسایی و بررسی انحرافات کیفیت محصول و نگهداری آزمایشگاه های کنترل قابل اعتماد است. این سیستم رسمی کنترل در یک شرکت داروسازی، اگر به اندازه کافی عملی شود، به جلوگیری از موارد آلودگی، اختلاط، انحراف، خرابی و خطا کمک می کند. این سیستم تولید تضمین می کند که محصولات دارویی با استانداردهای کیفی خود مطابقت دارند
Good manufacturing practice guidelines provide guidance for manufacturing, testing, and quality assurance in order to ensure that a manufactured product is safe for human consumption or use. Many countries have legislated that manufacturers follow GMP procedures and create their own GMP guidelines that correspond with their legislation.
دستورالعملهای GMP، راهنماییهایی را برای ساخت، آزمایش و تضمین کیفیت ارائه میدهند تا اطمینان حاصل شود که محصول تولید شده برای مصرف یا استفاده انسان ایمن است. بسیاری از کشورها قانون گذاری کرده اند که تولیدکنندگان از رویه های GMP پیروی می کنند و دستورالعمل های GMP خود را ایجاد می کنند که با قوانین آنها مطابقت دارد.
***
حال به نظر می رساند نظارت سازمان غذا و دارو بر داشتن GMP و در تدام آن cGMPچندان موثر و کارآمد نبوده است که نواقص سیستم بویژه در مرحله خرید مواد اولیه و سپس کنترل کیفیت و حتی تضمین کیفیت را ضمانت و جان بیماران را نجات دهد . پس مدیرعامل پرقدرت و مدیر تضمین کیفیت و مسئول فنی و ....در داخل کارخانه تنها مسئول نیستند ، این سازمان غذت و دارو در وزارت بهداشت ، درمان و آموزش پزشکی است که نظارت ناکافی بر سیستم های تولید داشته است که نتوانسته عوامل انسانی را تولید دارو کم و به حداقل برساند و کنترل سیستمی را به صورت استوار در قالب GMP داشته است.

داروسازی شهید قاضی این نامه را پنهان کرده است ..چون در آن اشاره به ضرورت تعمیرات نشده است و نامه موخر است ...
دکتر حیدر محمدی معاون وزیر و رییس سازمان غذا و دارو است ، ایشان دارای حق وتو نظرات کارشناسان دقیق خود را دارد و می تواند به تنهایی جور آنان را بکشد و به کارخانه فاقد گواهینامهGMP ؛ مجوز راه اندازی بدهد، شرکتی که در دوران کرونا به بهانه نداشتن آن گواهینامه یعنی GMP خطوط تولید خود را خاموش و موجب واردات سرم های کمتر تایید شده به کشور گردید و کشور را با بحران کمبود سرم مواجه ساخت و ثروتی عظیم را به بهانه واردات سرم در بحران کمبود از کشور خارج ساخت ! تا کسی نپرسد این همه مدت تعطیلی برای چه بود و میلیاردها هزینه از جیب بیمه گزاران هزینه شده به کجا رفت !

داروسازی شهید قاضی با تعطیلی دراز مدت در بحرانی ترین شرایط جامعه به بهانه نوسازی و اصلاح به جهت حفظ استاندارد و دستورالعمل های GMP نتوانست گواهی GMP را از کارشناسان دقیق و صدیق سازمان غذا و دارو دریافت دارد... آیا امکان تکرار ماجرای داروسازی ثامن با توجه به سوابق داروسازی شهید قاضی در تولید استامینوفن آلوده و صادرات آن وجود ندارد؟ چگونه آقای معاون وزیر در دولت گذشته و حاضر در دولت فعلی، مجوز تولید را علیرغم گزارش مستند خطا به شرکت می دهد ، آیا او مالک جان انسان هاست؟



گزارش بازرسان دقیق و صدیق سازمان غذا و دارو حاوی نکات مشخصی است که نشانگر تهدید سلامتی سرم و فقدان GMP را نشان می دهد و مشخص نیست ماه ها تعطیل کارخانه به چه منظور بوده است . آقای حیدر محمدی بدین شرح در سطور پایانی نامه خود در صفحه سوم نوشته و امضا کرده است:
" لازم به ذکراست تمام بندهایی که در آن به عدم وجود دستورالعمل و یا نقص آن اشاره می شود ؛ بدین معنا ( معنی ) است که عملیات اجرایی مربوطه هم ناقص یا مشکل دار انجام می شود.
مقتضی است ظرف مدت یک ماه از تاریخ دریافت این گزارش برنامه زمانبندی شده عملیات اصلاحی برای رفع نواقص این بازدید به این اداره کل ارسال دارید ."

کمی بعد از یک ماه و یک هفته از نامه ی رییس سازمان غذا و دارو به داروسازی شهید قاضی و علیرغم لحاظ و اشاره آقای حیدر محمدی به نامه قبلی خود ؛ به بهانه نیاز کشور مجوز تولید سرم به دارو سازی شهید قاضی داده می شود. و مغایرت های تولید همچنان باقی می مانند! آن همه پول چه شدند و نتیجه کار چرا غلط از آب درآمد؟
آیا آقای دکتر حیدر محمدی می تواند بر خلاف آیین نامه های دارو به یک شرکت دارای مشکل مجوز تولید بدهد؟
این همان راز مرگ ده ها انسان بی گناه است که بجای »«شفاء» (با کسره روي حرف ش) «شِفاء» (با فتحه روي حرف ش) یافتند و بنا به مصلحت های قدرتمداران مرگ آنها حق و طبیعی قرار بود قلمداد شود! که آن هم نشد ، بالاخره خون گریبانگیر است و بس!
ظفر حسن زاده تبریزی
∎